 Загадочные процессы на Марсе раскрыли новый секрет существования планеты
Загадочные процессы на Марсе раскрыли новый секрет существования планетыЗагадочные хлорные выбросы на Марсе: новые данные с орбитального аппарата Экзомарс-TGO
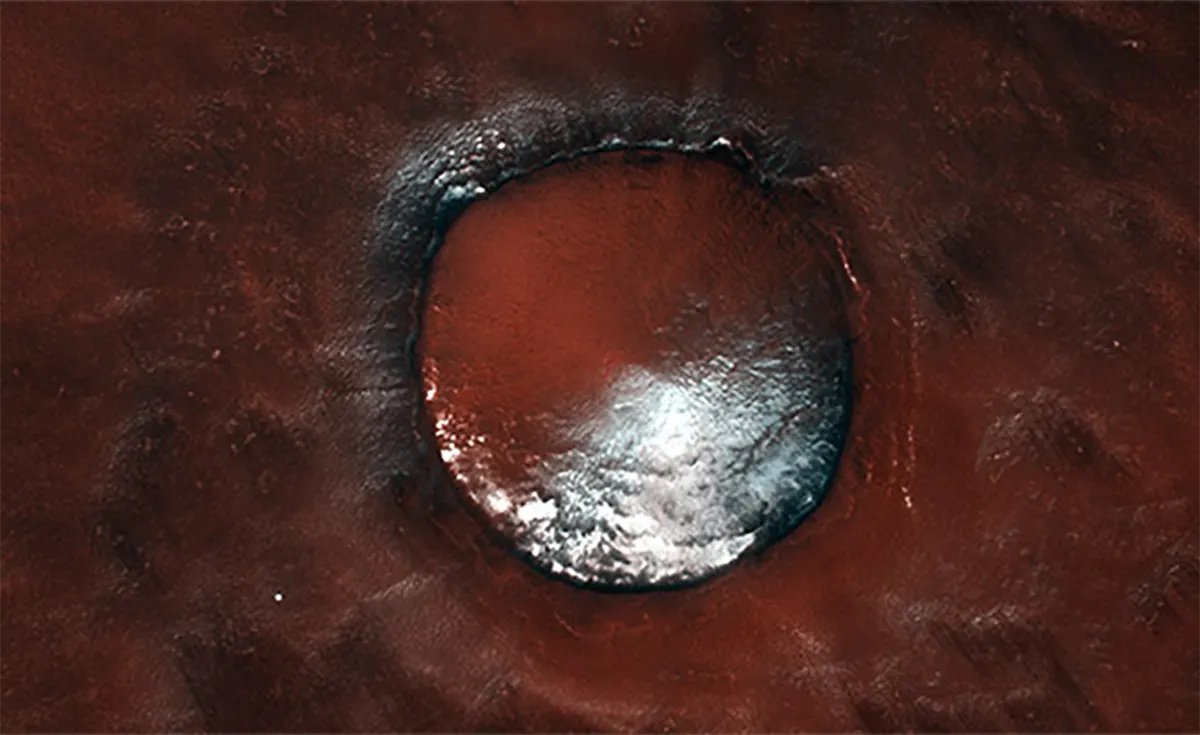
: UEFIMA.RU: Недавнее открытие, сделанное при помощи российского прибора ACS, установленного на борту орбитального аппарата "Экзомарс-TGO", проливает новый свет на загадочные процессы, происходящие в атмосфере Марса.
Ученые зафиксировали необычные, резко локализованные выбросы соединений хлора, имеющие "точечный" характер и расположенные в непосредственной близости от поверхности планеты.
Открытие, объявленное Михаилом Лугининым из Института космических исследований РАН на XV Московском симпозиуме по исследованиям Солнечной системы, значительно расширяет наши представления о геохимической активности Красной планеты и ставит перед учеными ряд новых, захватывающих вопросов.
Наблюдения, проведенные в течение марсианского года (с декабря 2022 по ноябрь 2024 года), выявили корреляцию между интенсивностью выбросов хлора и положением Марса на орбите вокруг Солнца.
Пик концентрации соляной кислоты и других хлорсодержащих соединений был зафиксирован в период афелия – точки орбиты, наиболее удаленной от Солнца.
Этот факт сам по себе является крайне интригующим, поскольку солнечная радиация обычно играет ключевую роль в фотохимических процессах в атмосферах планет.
Неожиданное усиление выбросов хлора именно в период минимального солнечного воздействия указывает на эндогенные, внутренние источники этих газов.
Гипотеза о "спящих" вулканах, озвученная Лугининым, является одной из наиболее вероятных. Вулканическая активность, даже в минимальной форме, способна высвобождать в атмосферу газы, в том числе и хлорсодержащие.
Однако, характер выбросов – резко локализованные "точечные" источники – пока не находит полного объяснения в рамках этой гипотезы.
Возможно, это связано с уникальной геологической структурой Марса, например, с наличием специфических геологических разломов, по которым выходят на поверхность газы из глубоких недр планеты.
Более того, ранние исследования уже показали присутствие в атмосфере Марса значительных количеств паров соляной кислоты, что само по себе стало сенсацией.
Предыдущие модели атмосферы Марса не предсказывали такого явления.
Зафиксированные случаи практически мгновенного исчезновения паров соляной кислоты из атмосферы добавляют загадочности этой картине.
Возможные механизмы исчезновения включают адсорбцию газов на поверхности марсианского грунта, образование твердых солей хлора, а также реакции с другими компонентами атмосферы.
Для полного понимания происходящих процессов необходимо проведение дополнительных исследований. Это включает в себя более детальное картографирование "точечных" источников выбросов хлора, анализ изотопного состава хлора для определения его происхождения, и углубленное моделирование атмосферных процессов с учетом всех известных данных.
Будущие миссии на Марс, включая возможность использования посадочных модулей с высокочувствительной аппаратурой для непосредственного анализа марсианской почвы и атмосферы вблизи обнаруженных источников, могут дать нам более полную картину и помочь разгадать загадку марсианских хлорных выбросов.
Изучение этих выбросов может рассказать нам многое о геологической истории Марса, о его внутреннем строении и о возможности существования жизни в прошлом.
В частности, наличие хлора в марсианской воде может указать на возможность протекания химических реакций, необходимых для зарождения жизни.
Более того, исследование марсианских вулканов и их активности может дать ценную информацию о тектонике планеты и о процессах, которые формировали ее поверхность на протяжении миллиардов лет.
Поэтому исследование хлорных выбросов является не просто научной интригой, а ключом к пониманию эволюции Марса и поискам жизни за пределами Земли.
Хлор: от лаборатории до повседневной жизни
Хлор – это яркий представитель группы галогенов в периодической таблице элементов.
Его атомный номер 17, а символ – Cl. Этот зеленовато-желтый газ обладает высокой химической активностью, что делает его незаменимым во многих отраслях промышленности и быта.
Распространенность и свойства
Хлор – один из самых распространенных элементов на Земле. Он встречается в природе в виде соединений, таких как хлориды натрия (поваренная соль), калия и магния.
Высокая реакционная способность хлора обусловлена его электроотрицательностью – стремлением присоединять электроны. Это свойство позволяет ему образовывать прочные химические связи с большинством элементов.
Роль хлора в промышленности и быту
Производство химических веществ: Хлор является ключевым компонентом при производстве множества химических соединений, включая поливинилхлорид (ПВХ), хлороформ, хлорную известь и другие.
Эти вещества широко используются в различных отраслях промышленности.
Очистка воды: Хлор и его соединения применяются для обеззараживания питьевой воды и воды в бассейнах. Хлорирование эффективно уничтожает бактерии, вирусы и другие микроорганизмы.
Производство бумаги: Хлор используется для отбеливания целлюлозы при производстве бумаги.
Текстильная промышленность: Хлор и его соединения применяются для отбеливания и дезинфекции тканей.
Фармацевтика: Многие лекарственные препараты содержат хлор или его соединения.
Соединения хлора
Хлор образует огромное количество соединений с различными элементами. Наиболее распространены хлориды – соли соляной кислоты. Кроме хлоридов, известны гипохлориты, хлораты и перхлораты.
Хлориды: Наиболее известный хлорид – натрия хлорид (NaCl), или поваренная соль. Хлориды широко распространены в природе и используются в различных отраслях промышленности.
Гипохлориты: Соли хлорноватистой кислоты. Находят применение в качестве дезинфицирующих средств.
Хлораты: Соли хлорноватой кислоты. Используются в производстве взрывчатых веществ и спичек.
Перхлораты: Соли хлорной кислоты. Применяются в качестве окислителей в ракетном топливе и пиротехнике.
Опасность хлора
Несмотря на свою полезность, хлор является токсичным газом. При вдыхании он раздражает дыхательные пути и может вызвать отек легких.
Высокие концентрации хлора опасны для жизни. Поэтому при работе с хлором необходимо соблюдать меры предосторожности.
Хлор был открыт в 1774 году шведским химиком Карлом Шееле.
В природе встречаются два стабильных изотопа хлора: хлор-35 и хлор-37. Хлор входит в состав многих органических соединений, таких как хлорофтор углероды (фреоны), которые ранее широко использовались в качестве хладагентов.
Опубликовано 2024-10-22.


